1869-2019: 150 anni dalla pubblicazione della Tavola Periodica degli Elementi
Un secolo e mezzo fa, precisamente il 6 marzo 1869, il grande scienziato russo Dmitrij Mendeleev, docente di chimica all’Università di San Pietroburgo, pubblicava una tabella, la tavola periodica degli elementi, che organizzava in modo geniale e incredibilmente potente le conoscenze sulla materia fino ad allora possedute. Questa costruzione mentale era destinata a godere nella scienza di un successo straordinario.
Si tratta, ancora oggi, di una delle più mirabili conquiste non solo nella storia della chimica, ma più in generale dell’intero intelletto umano, è la scoperta di connessioni logiche e coerenti e all’epoca anche inaspettate tra i mattoni fondamentali del nostro universo. Infatti, offre allo studioso un ponte di collegamento affascinante tra il mondo a noi familiare delle esperienze quotidiane, che spesso chiamiamo macroscopico, e quello invisibile a occhi nudi e governato da leggi sorprendenti e contro-intuitive degli atomi e delle molecole, ovvero la dimensione microscopica.
La tavola periodica di Mendeleev era molto diversa da quella attuale, sia perché gli elementi nel 1869 erano elencati in ordine crescente di peso atomico e non, come oggi, di numero atomico, essendo all’epoca, questo concetto ancora sconosciuto, ma soprattutto perché molti elementi non erano ancora stati scoperti. Tuttavia, quella che poteva sembrare, apparentemente, una grave lacuna della costruzione mentale del grande chimico russo, è stata invece uno dei suoi più brillanti successi. Infatti, Mendeleev, lasciò appositamente nella sua tavola periodica alcuni posti vacanti, proprio in corrispondenza degli elementi ancora incogniti, ma servendosi della tabella e della legge di periodicità, che aveva elegantemente formulato, riuscì perfino a predirne molte delle proprietà chimico-fisiche e ad indirizzare gli sforzi dei suoi successori verso l’identificazione e la scoperta di questi elementi ancora sconosciuti. Pochi anni dopo la pubblicazione del sistema periodico di Mendeleev furono, infatti, svelati i tre elementi chiamati scandio, germanio e gallio, che andarono ad occupare alla perfezione le tre caselle vuote che aveva lasciato il grande scienziato russo, consacrando in modo imperituro la sua profetica intuizione.

Come spesso accade nella chimica e più in generale nella scienza, anche la formulazione del sistema periodico non fu il risultato di un genio solitario, ma piuttosto il frutto di numerose interazioni, discussioni, scambi di idee e lavoro di squadra. Possiamo affermare che a questa fondamentale scoperta contribuì in modo rilevante anche il chimico palermitano Stanislao Cannizzaro, che in un congresso internazionale a Karslruhe in Germania nel 1860 condivise con la comunità chimica dell’epoca le sue importanti ricerche sul concetto di atomo e di molecola e soprattutto propose un metodo sperimentale per la determinazione dei pesi atomici degli elementi, che fu alla base dell’opera di sistematizzazione e classificazione del suo collega Dimitri Mendeleev.
La tavola periodica rappresenta ancora oggi non solo un prezioso ausilio tecnico nel lavoro dei chimici, ma anche un valido strumento didattico per l’insegnamento della materia. Non occorre conoscere a memoria le proprietà di tutti gli elementi chimici, ma è sufficiente individuarne la posizione all’interno di questa eccezionale tabella per riuscire a predire con ragionevole precisione le proprietà chimico-fisiche, la reattività e perfino la struttura microscopica di quel particolare mattoncino del nostro universo.
Dagli iniziali 63 elementi riportati nell’originale schema di Mendeleev oggi siamo arrivati a 118. Gli ultimi sono stati scoperti nel 2015, grazie al notevole progresso tecnico e scientifico che ha permesso con l’impiego di potenti acceleratori di particelle di sintetizzare elementi superpesanti, artificiali e radioattivi come il nihonio, il moscovio, il tennesso e l’oganesso di numeri atomici rispettivamente 113, 115, 117 e appunto 118.
Come è noto da vecchie reminiscenze scolastiche, la tavola periodica è articolata in righe orizzontali chiamate periodi e in colonne verticali denominate gruppi. Ad esempio, sull’estrema sinistra trova posto il gruppo dei metalli alcalini, che annovera al suo interno gli elementi più elettropositivi, cioè quelli che presentano una spiccata tendenza a cedere elettroni e così a ionizzarsi per diventare cationi positivi.
Invece sul lato destro della tavola troviamo, come penultimo gruppo, quello degli alogeni, che al contrario dei metalli alcalini tendono ad attrarre elettroni per formare anioni negativi.
Tra i periodi di particolare interesse bisogna segnalare sia quello dei metalli di transizione, che include la maggior parte dei metalli di uso applicativo, sia i periodi dei lantanoidi e degli attinoidi, che risultano staccati dalla loro naturale posizione e riportati invece in basso. Sono i periodi a cui corrisponde il riempimento degli orbitali atomici di tipo f e tra di essi compaiono sia elementi artificiali, sia alcuni elementi radioattivi. In ogni caso sono elementi molto rari in natura, ma posseggono insolite proprietà chimico-fisiche tali da renderli utili ed estremamente appetibili in svariate applicazioni tecnologiche.
Proprio in riferimento all’abbondanza relativa degli elementi sul nostro pianeta, è stata presentata al parlamento di Strasburgo dall’Associazione Europea per le Scienze Chimiche e Molecolari – EuChemS anche una particolare tavola periodica, che mette in immediata evidenza i cosiddetti elementi a rischio estinzione nei prossimi cento anni.
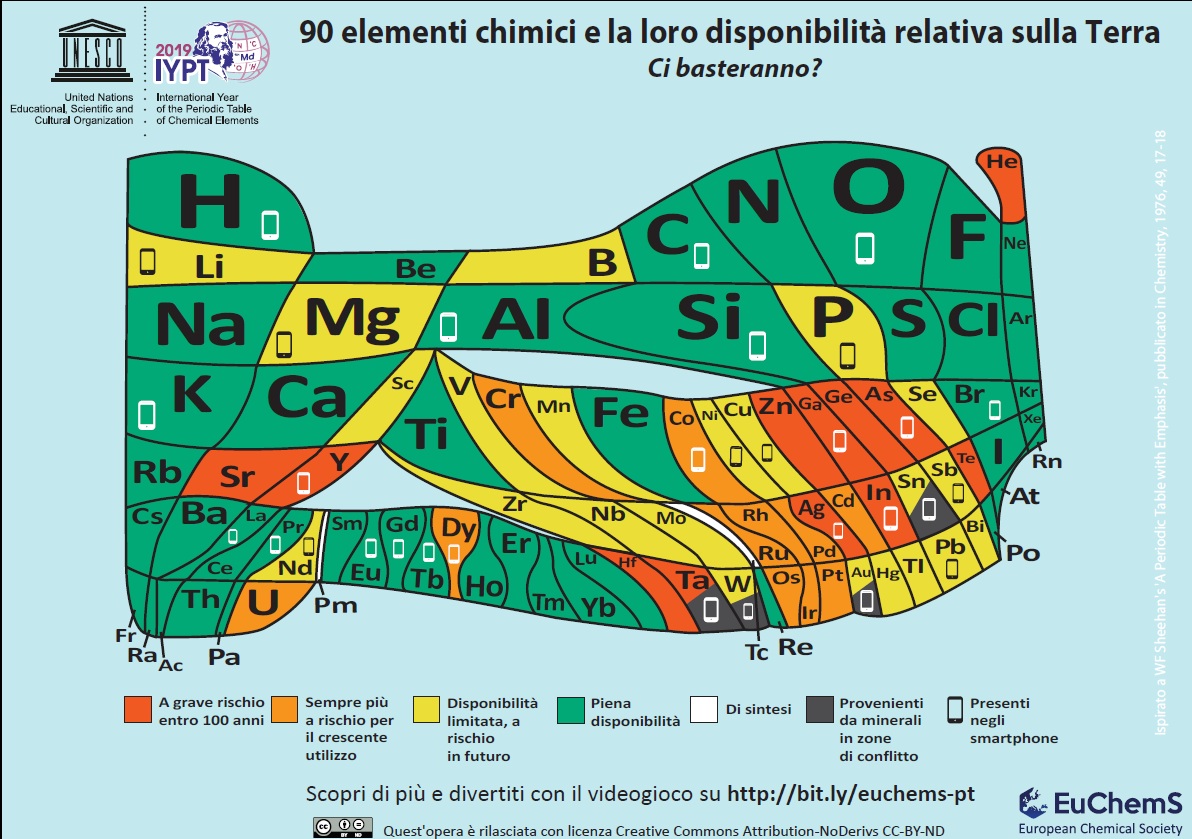
Abbondanza relativa dei 90 elementi principali (fonte: EuChemS)
Si tratta di quegli elementi chimici, che non solo sono intrinsecamente scarsi sulla crosta terrestre, ma trovando ampio impiego in prodotti di largo consumo, come smartphone e altri dispositivi elettronici, che purtroppo non sono recuperati attraverso opportuni processi di riciclaggio, finiscono direttamente nelle discariche e sono pertanto in via di totale esaurimento.
Infine, recentemente è stata proposta, per motivi didattici, sull’autorevole rivista scientifica Nature Chemistry (https://www.nature.com/articles/s41557-019-0253-6) un’interessante rivisitazione della classica tavola periodica, al fine di renderne più intuitiva e immediata la comprensione anche ai profani. Infatti, l’idea che sottende la costruzione della tabella è il riempimento degli orbitali atomici secondo il principio, noto in chimica, con il nome tedesco di aufbau. Generalmente, il riempimento di un contenitore, ad esempio, avviene dal basso verso l’alto, mentre l’attuale tavola riporta gli elementi sotto forma di una lista da sinistra verso destra, ma in senso opposto, ovvero dall’alto verso il basso. Invece, in questa nuova formulazione, viene contrapposta alla convenzionale visione della tavola come elenco, quella alternativa di contenitore per il riempimento degli orbitali atomici.
In questa schematizzazione è stato rovesciato il punto di vista dell’osservatore, nel senso che si parte appunto dal basso e poi si procede a salire, fino ad arrivare ai lantanoidi e agli attinoidi, che acquistano così anche maggiore risalto, coerentemente con l’importanza sempre crescente di questi elementi nelle applicazioni di alta tecnologia.
Concludendo, a ragion veduta, quindi, si può condividere la scelta dell’Unesco di dedicare il 2019 proprio alla commemorazione ed alla promozione della tavola periodica degli elementi, che non sfigura affatto accanto alle grandi opere dell’ingegno umano sia scientifiche, come la relatività generale di Albert Einstein, che letterarie, come la Commedia di Dante Alighieri.




